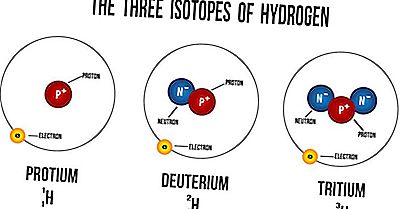
Was ist ein Isotop?
Isotope sind Atome desselben Elements, die eine gleiche Anzahl von Protonen, aber eine unterschiedliche Anzahl von Neutronen aufweisen. Ihre Ordnungszahlen sind gleich, aber ihre Massenzahlen sind unterschiedlich. Massenzahlen werden immer mit A bezeichnet, während Z sich auf die Ordnungszahlen von Elementen bezieht. Die Ordnungszahl symbolisiert die Anzahl der Protonen im Kern eines Atoms und wird verwendet, um die Position des Elements im Periodensystem zu identifizieren. Die Massenzahl eines Atoms ist die Anzahl der Neutronen in seinem Kern. Die Isotope von Elementen haben aufgrund der Variation ihrer Atommassen unterschiedliche physikalische Eigenschaften. Aufgrund dieses Unterschiedes haben solche Isotope unterschiedliche Dichten sowie Schmelz- und Siedepunkte. Isotope eines Elements haben jedoch immer sehr ähnliche chemische Eigenschaften. Die Ähnlichkeit tritt auf, weil nur die Elektronen in chemischen Reaktionen verwendet werden, nicht die Neutronen oder Protonen.
Geschichte der Isotope
Der Radiochemiker Fredrick Soddy schlug zuerst die Existenz von Isotopen in 1913 vor, nachdem er Studien durchgeführt hatte, die den Zerfall radioaktiver Ketten beinhalteten. Während seiner Experimente erkannte Soddy, dass vierzig verschiedene Spezies zwischen Blei und Uran existierten, aber das Periodensystem konnte nur 11-Atome aufnehmen. Nachdem chemische Tests zur Trennung einiger dieser Elemente fehlgeschlagen waren, schlug er vor, dass mehr als ein Atomtyp die gleiche Position im Periodensystem einnehmen könnte und nannte sie Isotope.
Beispiele für Isotope
Chlor enthält zwei Hauptisotope: Chlor-35 und Chlor-37. Um zu dieser Schlussfolgerung zu gelangen, haben Wissenschaftler entdeckt, dass in einer Chlorsubstanz die Anteile jedes dieser Isotope insgesamt vorhanden sind, und deshalb werden Verhältnisse verwendet, um den Mengenunterschied auszudrücken. Diese Verhältnisse sind hilfreich, wenn relative Prozentsätze und relative Atommassen berechnet werden. Andere Beispiele von Isotopen umfassen Kohlenstoff (Kohlenstoff-12- und Kohlenstoff-14-Isotope), Sauerstoff (Sauerstoff-16 und Sauerstoff-18) und Phosphor (Phosphor-31 ist das primäre Isotop, obwohl auch spezifische Mengen an Phosphor-32 existieren). Die Isotope dieser Verbindungen gelten als stabil, und die meisten von ihnen haben nur zwei Isotope. Es gibt jedoch einige Elemente, die nur ein Isotop haben, und dazu gehören Fluor, Beryllium, Arsen, Yttrium, Gold, Aluminium, Jod, Mangan, Natrium und Niob.
Reinigung von Isotopen
Es gibt drei Hauptbereiche, in denen Isotope angewendet werden. Die erste ist die Trennung von Isotopen. Die Trennung erleichtert die Maximierung der Eigenschaften der Atome nach Bedarf. Bei der Trennung leichterer Elemente wie Deuterium und Sauerstoff kommt die Gasdiffusionsmethode zum Einsatz. Die Trennung von schweren Elementen wie Uran und Plutonium erfolgt durch Massenspektrometrie.
Anwendung von Isotopen
Die erste Anwendung von Isotopen ist die Verwendung von Kohlenstoffdatierungen durch Archäologen. Isotope sind zwei Arten: stabile und radioaktive Isotope. Stabile Isotope enthalten die gleiche Kombination von Protonen und Neutronen und unterliegen daher keinem Zerfall. Auf der anderen Seite haben die radioaktiven Isotope instabile Kerne und unterliegen somit einem Zerfall. Der radioaktive Zerfall kann so lange dauern wie 5,730 Jahre, wie das Kohlenstoffelement. Archäologen verwenden diese Komponente von Isotopen, um das Alter eines Objekts zu bestimmen, das in archäologischen Ausgrabungen gefunden wird.








